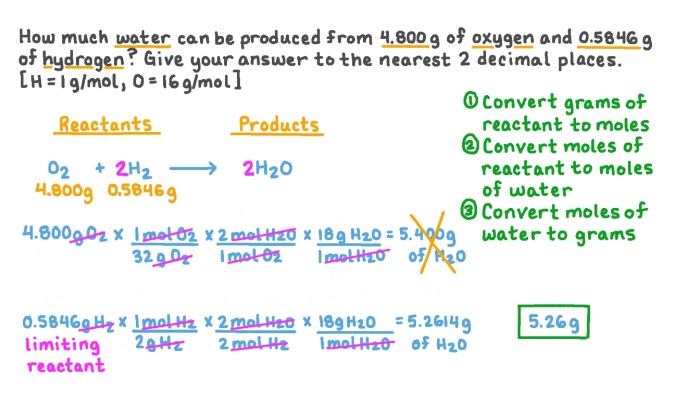
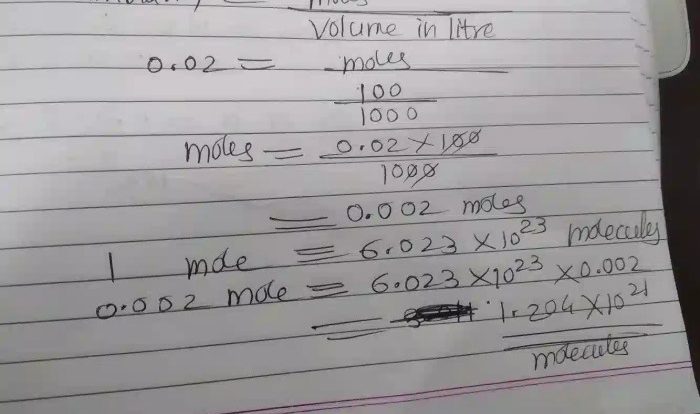Covalent bonding worksheet and answers is an indispensable resource for students and educators seeking to delve into the intricacies of chemical bonding. This comprehensive guide provides a thorough understanding of covalent bonding fundamentals, Lewis structures, molecular orbitals, bond properties, resonance, and its applications in the real world.
Through engaging explanations, illustrative examples, and practice exercises, this worksheet empowers learners to grasp the concepts of covalent bonding, predict molecular geometry, and explore the factors influencing bond properties. Moreover, it highlights the practical significance of covalent bonding in various scientific disciplines, making it an invaluable tool for anyone interested in chemistry, materials science, and biochemistry.
1. Covalent Bonding Fundamentals
Covalent bonding adalah jenis ikatan kimia di mana dua atom berbagi pasangan elektron. Pembagian elektron ini membentuk ikatan kovalen yang menahan atom-atom tersebut bersama-sama.
Contoh molekul yang terbentuk melalui ikatan kovalen meliputi:
- H 2(hidrogen)
- Cl 2(klorin)
- CH 4(metana)
Elektronegativitas adalah ukuran seberapa kuat suatu atom menarik elektron. Perbedaan elektronegativitas antara dua atom menentukan kekuatan ikatan kovalen. Semakin besar perbedaan elektronegativitas, semakin kuat ikatannya.
2. Lewis Structures and VSEPR Theory: Covalent Bonding Worksheet And Answers
Struktur Lewis adalah representasi diagram dari ikatan kimia dalam suatu molekul. Struktur Lewis dapat digunakan untuk memprediksi geometri molekul menggunakan VSEPR (Valence Shell Electron Pair Repulsion) theory.
Prinsip-prinsip VSEPR theory meliputi:
- Pasangan elektron tolak-menolak satu sama lain.
- Geometri molekul ditentukan oleh jumlah pasangan elektron ikatan dan pasangan elektron bebas di sekitar atom pusat.
Contoh aplikasi VSEPR theory:
- CH 4(tetrahedral)
- NH 3(trigonal piramidal)
- H 2O (bengkok)
3. Molecular Orbitals

Orbital molekul adalah daerah di sekitar inti di mana elektron kemungkinan besar ditemukan. Dalam ikatan kovalen, orbital atom bergabung untuk membentuk orbital molekul.
Jenis orbital molekul meliputi:
- Sigma (σ) bond: tumpang tindih langsung antara orbital atom.
- Pi (π) bond: tumpang tindih lateral antara orbital atom.
Hibridisasi adalah proses mencampur orbital atom untuk membentuk orbital hibrid dengan bentuk dan energi yang berbeda. Hibridisasi terjadi dalam ikatan kovalen untuk memaksimalkan tumpang tindih orbital.
Essential Questionnaire
What is covalent bonding?
Covalent bonding is a type of chemical bond formed when atoms share one or more pairs of electrons, resulting in a stable electron configuration for each atom.
How do you draw Lewis structures?
Lewis structures are diagrams that represent the bonding between atoms in a molecule. To draw a Lewis structure, start by determining the total number of valence electrons in the molecule. Then, connect the atoms with single bonds, and distribute the remaining electrons as lone pairs or multiple bonds to satisfy the octet rule for each atom.
What is VSEPR theory?
VSEPR theory (Valence Shell Electron Pair Repulsion) is a model used to predict the molecular geometry of a molecule based on the number and arrangement of electron pairs around the central atom.